- 联系我们
- QQ:517136954
微信:LL1230505
- 搜索
-
如何基于一条老旧的TGF-β信号通路,来发近6分纯生信文呢?
作者:zxn123 | 发布于:2023年03月30日 | 浏览:999 次
-
添加微信
AZDX128(广告招租联系我)
添加微信撰写:生信小师妹 来源:小张聊科研平台的“ i生信”公众号,微信公众号搜索“ i生信”即可关注/扫描关注见文末
#生信发文# #科研热点# #预后模型# #疾病治疗#
今天小编为大家带来1篇2022年11月发表在Front Pharmacol(IF 5.988)题为“Identification of TGF-β signaling-related molecular patterns, construction of a prognostic model, and prediction of immunotherapy response in gastric cancer”的文章。
原文链接:
/

PMID: 36467074
背景
TGF-β信号通路在肿瘤进展和免疫应答中起重要作用。然而,TGF-β信号通路相关基因(TSRGs)与胃癌临床预后、肿瘤微环境(TME)和免疫治疗之间的关系尚不清楚。
TGF-β可由大多数细胞通过自分泌和旁分泌形式产生,如肿瘤细胞、基质细胞和免疫细胞。TGF-β信号通路在胚胎发育、肿瘤进展和免疫反应中起着至关重要的作用。在早期肿瘤细胞中,TGF-β信号通路可以抑制增殖,诱导细胞周期阻滞和凋亡,被认为是一种肿瘤抑制因子。然而,在晚期肿瘤细胞中,TGF-β信号通路通过促进血管生成、诱导上皮-间充质转化(EMT)、调节基因组不稳定性和免疫逃逸等机制调节肿瘤复发和转移。此外,TME中成纤维细胞TGF-β信号通路激活诱导的胶原纤维限制T细胞向肿瘤细胞的浸润,从而抑制机体的抗癌免疫反应,被认为是一种免疫抑制细胞因子。目前,大多数研究只关注TGF-β信号通路中的一两个基因,而肿瘤的发生往往是大量基因相互作用的结果。因此,有必要系统分析TGF-β信号通路中多个基因与TME的关系,以发现新的、不同的免疫表型,筛选对免疫治疗敏感的人群,进行更精准的治疗。
展开全文
整体思路
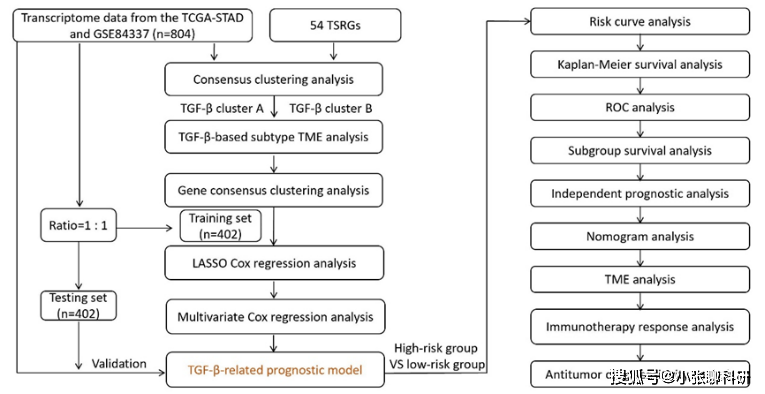
本研究从TCGA和GEO数据库中获得804份胃癌样本,从MSigDB中收集54个TGF-β信号通路相关基因(TSRGs)。作者分析了54种TSRGs在胃癌中的表达水平及基因突变特征,并根据54种TSRGs的表达水平将胃癌患者分为两个不同的TGF-β亚组(TGF-β cluster A 和 TGF-β cluster B)(第一次聚类),并分析了不同分子亚型在预后、临床病理特征和TME方面的差异。
随后,基于两个不同TGF-β亚群之间的差异表达基因(TGF-β clusters-related DEGs),再次聚类得到3个基因簇。
基于TGF-β clusters-related DEGs,使用LASSO回归构建并验证了一个TGF-β相关预后模型。根据中位风险评分将患者分为高危组和低危组。最后,还评估了高危组和低危组患者对免疫检查点抑制剂(ICIs)和抗肿瘤药物的敏感性。
具体成文思路
本研究从TCGA和GEO数据库中获得804份胃癌样本,从MSigDB中收集54个TGF-β信号通路相关基因(TSRGs)。
1、探究TSRGs在胃癌中的差异表达及其遗传变异谱
作者首先对54种TSRGs在胃癌组织和正常胃组织中的差异表达进行了分析,得到43个DEGs (图1A)。
基于String数据库的蛋白-蛋白相互作用网络分析揭示了大多数基因之间的密切联系(图1B)。
接下来,作者探讨了胃癌患者54个TSRGs的体细胞突变水平(图1C)和CNVs改变频率(图1D)及CNV的位置(图1E)。
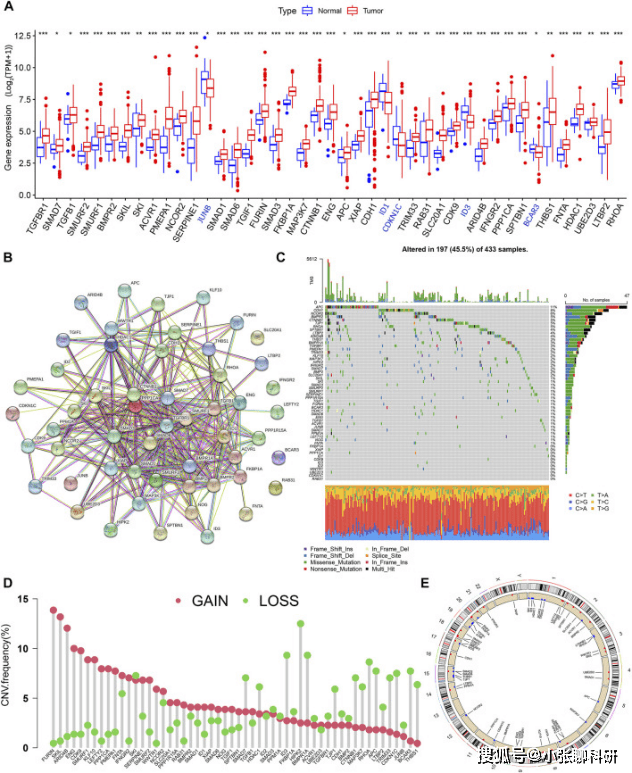
FIGURE 1 Genetic mutational characteristics of TSRGs in gastric cancer
2、构建TGF-β亚群:A和B,并分析了不同分子亚型在预后、临床病理特征及TSRGs表达方面的差异。
作者根据54种TSRGs的表达水平,将胃癌患者分为两个不同的TGF-β亚组TGF-β cluster A 和 TGF-β cluster B (图2A-C)。
PCA结果进一步证明了良好的分组效果(图2D)。Kaplan-Meier生存分析显示TGF-β cluster B具有更显著的生存优势(p < 0.001,图2E)。此外,作者结合TGF-β亚群和胃癌患者的临床病理特征绘制了54个TSRGs表达热图,发现与TGF-β聚类B相比,TGF-β聚类A中有54个TSRGs表达水平更高(图2F)。
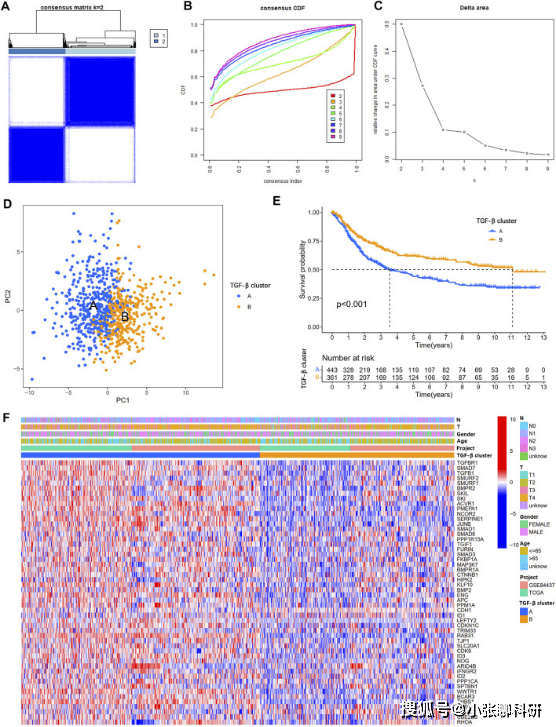
FIGURE 2 Overall survival and clinicopathological characteristics of two different TSRG subgroups.
3、继续,分析TGF-β亚群:A和B的肿瘤免疫微环境(TME)特征及差异
为了探索胃癌中TSRGs和TME之间的相关性,探索角度有:患者基质评分、免疫评分和ESTIMATE评分较高(图3A-C);对三个关键免疫检查点基因(PD1、PD-L1和CTLA4)的表达分析 (图3D-F);使用CIBERSORT算法进一步分析23个免疫细胞的浸润水平(图3G);GSVA富集分析显示,TGF-β cluster A 和 TGF-β cluster B所富集的信号通路(图3H)。
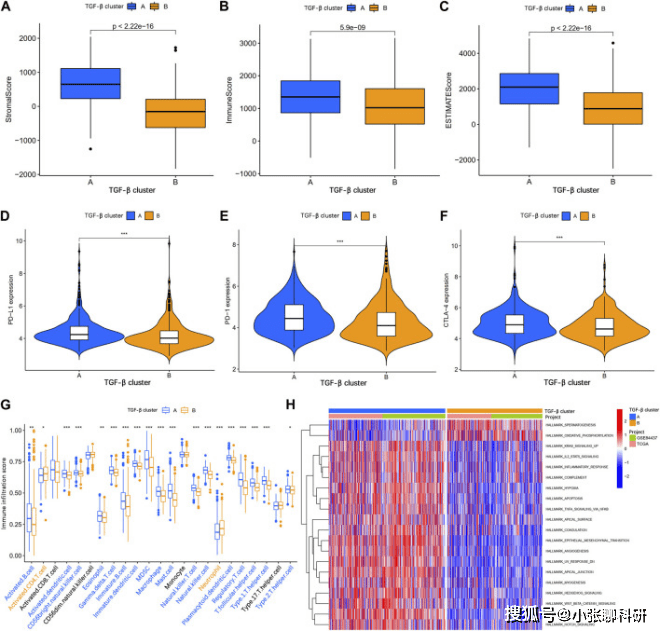
FIGURE 3 Analysis of the tumor immune microenvironment between two different TGF-β subgroups.
4、基于TGF-β clusters-related DEGs,确定基因簇
基于,TGF-β cluster A 和 TGF-β cluster B分组,作者使用R包limma获得了202个TGF-β clusters-related DEGs,并进行了功能富集分析,GO(图4A)和KEGG分析(图4B)。
然后,对202个TGF-β clusters-related DEGs 进行单因素Cox回归分析,获得了199个与胃癌患者预后(OS)相关的基因。
为了进一步探讨胃癌中与预后相关的DEGs的潜在机制,基于199个预后相关基因的表达水平,采用无监督一致性聚类分析将胃癌患者分为三个不同的基因簇,即gene cluster A, gene cluster B, and gene cluster C。然后进行了3个基因亚群的Kaplan-Meier生存分析 (图4C),临床病理特征和DEGs表达热图分析(图4D)以及54个TSRGs的表达差异分析(图4E)。
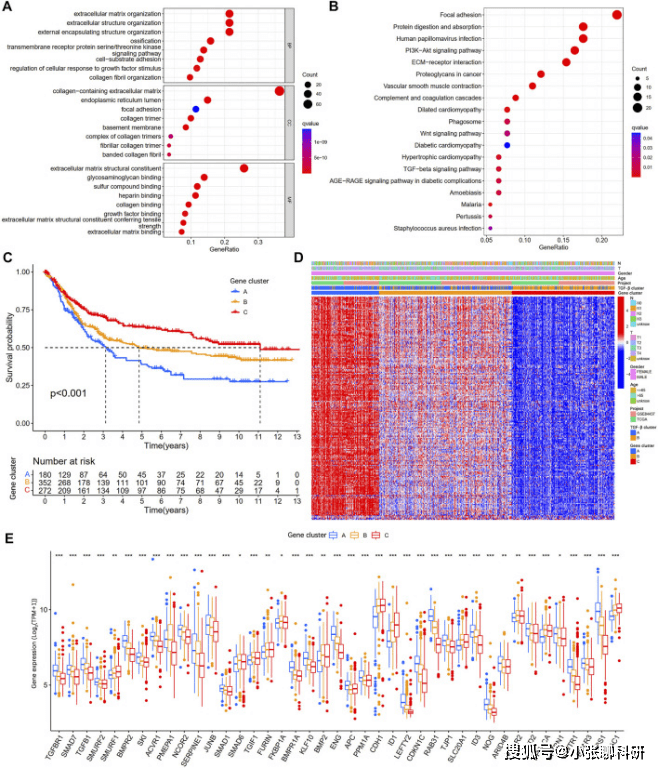
FIGURE 4 Identification of gene subgroups based on DEGs among two TGF-β subgroups.
5、基于TGF-β cluster-related prognostic DEGs,构建和验证预后风险模型
为了量化每个胃癌患者的风险,构建了一个基于TGF-β cluster-related prognostic DEGs的预后风险模型。
首先,使用R包将患者随机分配到训练集和测试集,比例为1:1。
其次,在训练集中,采用LASSO和多元Cox回归分析构建合适的风险模型。LASSO回归分析筛选出12个潜在候选基因(图5A,B)。随后对12个预后相关基因进行多因素Cox回归,得到5个用于构建风险模型的基因,分别为SRPX2、SGCE、DES、MMP7和KRT17。根据公式计算每位患者的风险评分 (图5C)。Sankey图显示了风险评分与TGF-β簇、基因簇、生存状态之间的相关性(图5D)。比较了TGF-β聚类与基因聚类的风险评分的差异(图5E,F)。
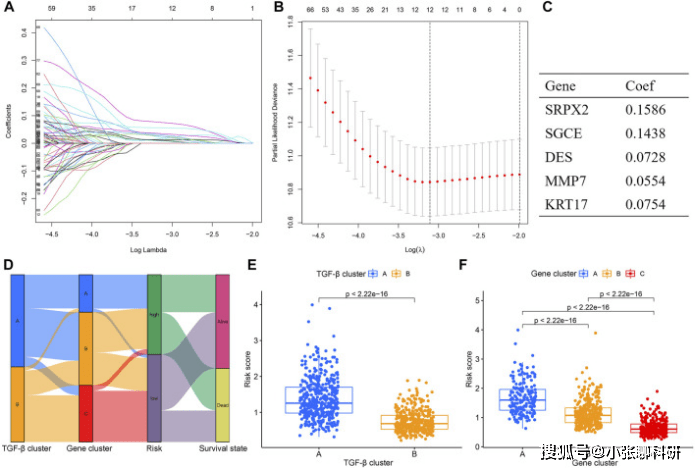
FIGURE 5 Construction of the TGF-β cluster-related DEGs prognostic model.
接下来,探究上述预后风险模型的预后价值。
根据中位风险评分将胃癌患者分为高危组和低危组。
首先在Training set中探究:风险评分曲线和生存状态散点图显示,胃癌患者死亡人数随着风险评分的增加而增加(图6A,B)。Kaplan-Meier生存分析显示,高危组患者的OS较低危组患者差(图6C)。风险评分的1、3、5年AUC值分别为0.612、0.668、0.694(图6D)。
同时,分别在两个验证集(the testing set and the entire set)中进行了相同的分析,得到了相似的结果(图6E-L)。进一步在IMvigor210队列中,验证所构建的预后模型的准确性(补充图S2A)。
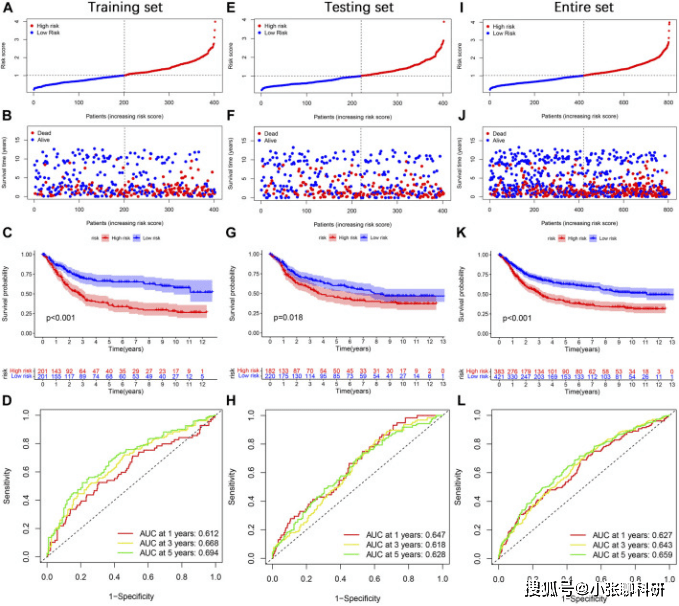
FIGURE 6 Prognosis value of the TGF-β cluster-related DEGs prognostic model.
6、风险模型的临床相关性分析和分层分析
为了探讨风险评分与现有临床病理特征之间的相关性,我们首先分析了临床亚组的风险评分差异((图7A-D)。亚组按照age, gender, T stage, and N stage进行分组。
对不同亚组进行Kaplan-Meier生存分析 (图7E-L)。
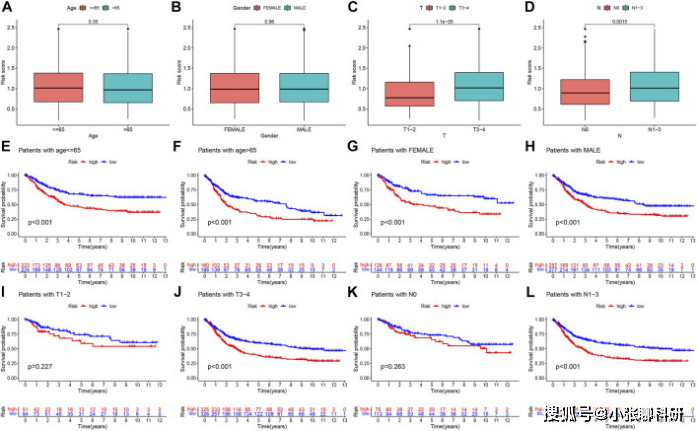
FIGURE 7 Prognostic model-based clinicopathological characteristics and survival subgroup analysis
7、探讨风险评分是否是胃癌患者的独立预后因素和绘制nomogram
结合临床病理特征,在训练集和两个验证集(the testing set and the entire set)中进行单变量和多变量Cox回归分析 (图8A-F),证实风险评分是胃癌患者的独立预后因素。(A,B) Univariate and multivariate Cox regression analyses of clinicopathological variables and risk scores with OS in the training set, (C,D) testing set, and (E,F) entire set.
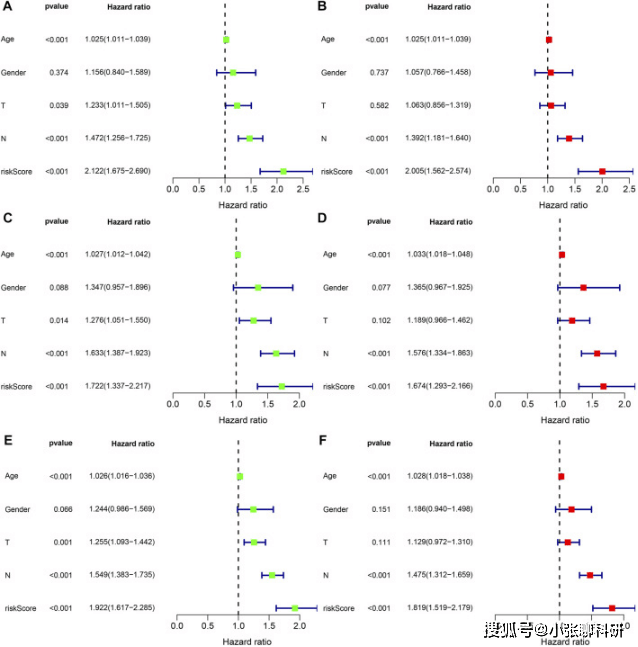
FIGURE 8 The independent prognosis analysis of the risk score and clinicopathological variables in gastric cancer.
鉴于胃癌患者的风险评分与预后密切相关,综合性别、年龄、T分期、N分期和风险评分,绘制nomogram,预测训练集和两个验证集(the testing set and the entire set)的1- 5年、3- 5年生存率(图9A、C、E)。1年、3年和5年的校准曲线比较nomogram预测OS与实际观测OS(图9B、D、F)。
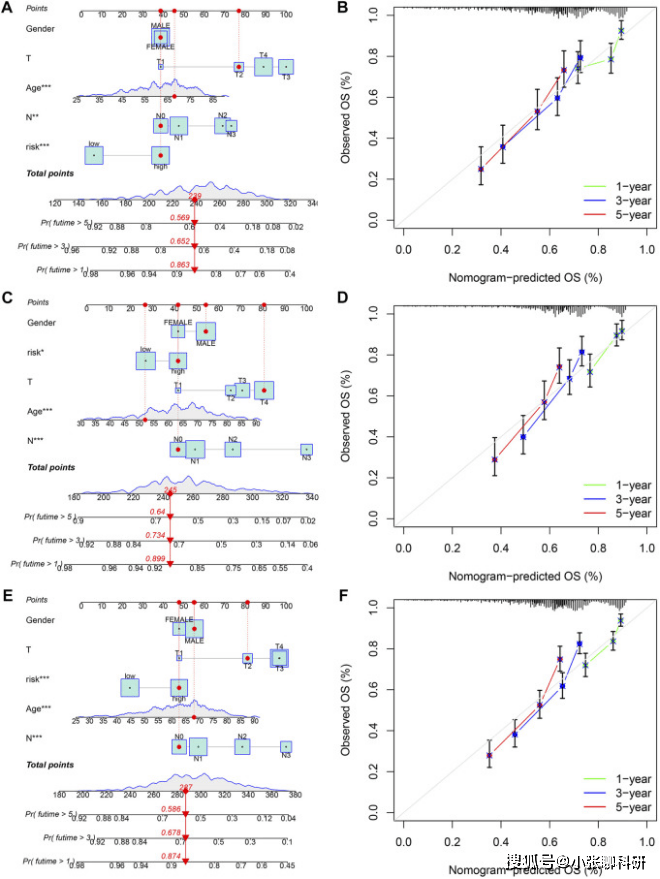
FIGURE 9 Construction and validation of a nomogram for predicting OS in gastric cancer.
8、探讨胃癌患者高危组和低危组肿瘤免疫微环境(TME)的差异
首先进行了ESTIMATE分析。结果显示高危组胃癌患者间质评分、免疫评分、ESTIMATE评分较高(图10A)。
随后,使用7种算法来评估免疫细胞浸润水平与风险评分之间的相关性,如图10B所示。
还将预后模型中的五个基因与免疫细胞之间进行了相关性分析(图10C)。
利用ssGSEA进一步探讨了两个亚组之间16种免疫细胞和13种免疫相关通路的差异 (图10D,E)。
最后,还分析了两个亚组之间免疫检查点相关基因的表达水平,图10F显示。
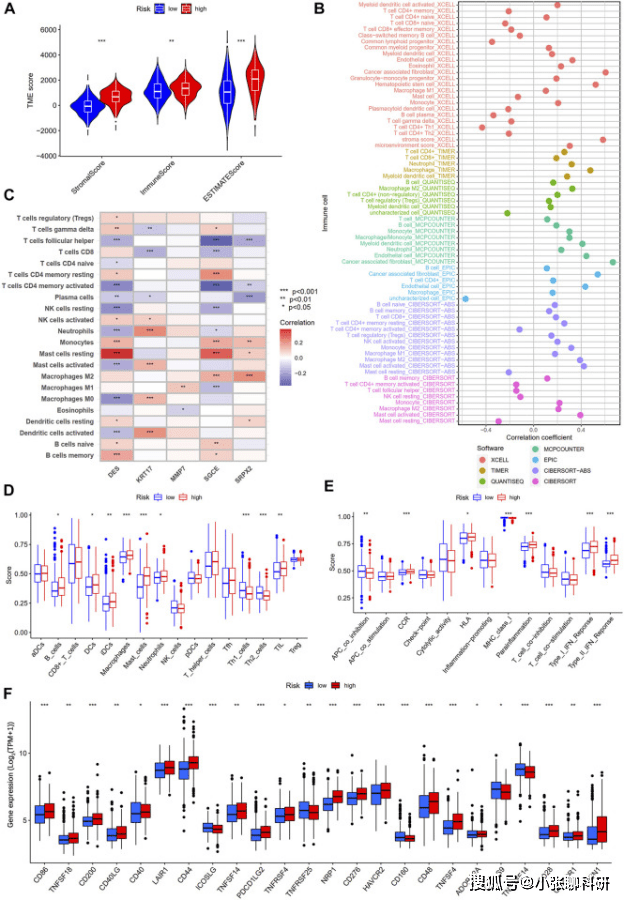
FIGURE 10 Differential analysis of tumor immune microenvironment between high- and low-risk groups.
9、免疫治疗反应分析
TMB和MSI被认为是肿瘤免疫治疗应答率的生物标志物, TMB和MSI- h高的患者受益于免疫治疗,生存期更长。因此,首先分析了TMB与风险评分之间的相关性 (图11A,B)。根据TMB和风险评分,分为四个亚组,然后进行Kaplan-Meier生存分析 (图11C)。进一步分析了胃癌患者高危组和低危组的体细胞突变 (图11D)。还分析了MSI与风险评分之间的相关性 (图11E)。
IPS和TIDE评分是新的肿瘤免疫治疗应答率生物标志物,可以更好地评估抗PD1和抗CTLA4治疗的疗效。IPS评分高代表免疫原性高,TIDE评分高代表肿瘤免疫逃逸的可能性更大。因此,IPS越高,TIDE评分越低,患者的免疫治疗效果越好。接下来就探究风险评分与IPS和TIDE评分,以及dysfunction, and exclusion score之间的关系(图11F-L)。还基于IMvigor210队列进行免疫治疗应答分析 (补充图S2B)。以上结果提示低危组胃癌患者可能对免疫治疗更敏感。
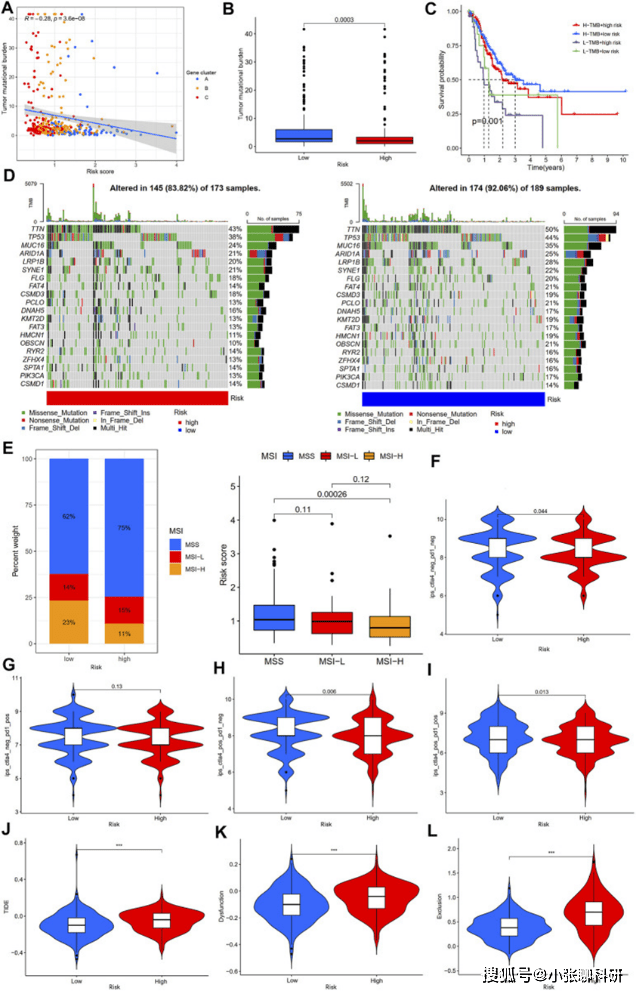
FIGURE 11 Analysis of immunotherapy response rates between high- and low-risk groups.
10、作者还分析了常见抗肿瘤药物在高危组和低危组间的敏感性差异,为临床抗肿瘤药物联合用药策略提供了新的视角(图12)。
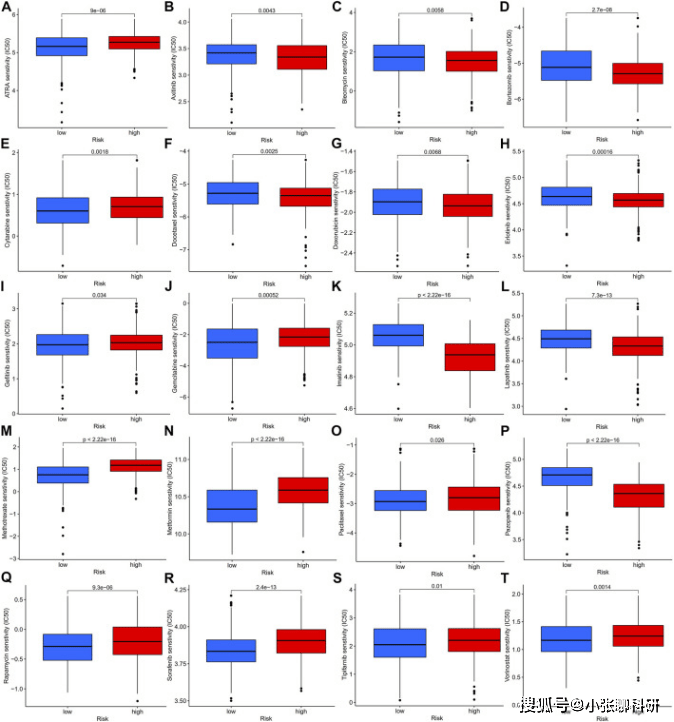
FIGURE 12 Antitumor drug sensitivity analysis of gastric patients in high- and low-risk groups
原文链接:
添加微信
AZDX128(广告招租联系我)
添加微信

额 本文暂时没人评论 来添加一个吧
发表评论